domingo, 24 de março de 2013
domingo, 17 de março de 2013
Soluções
Solução
Origem: Wikipédia, a enciclopédia livre.
| Este artigo ou secção cita fontes fiáveis e independentes, mas elas não cobrem todo o texto. Por favor, melhore este artigo providenciando mais fontes fiáveis e independentes, inserindo-as em notas de rodapé ou no corpo do texto, nos locais indicados. Encontre fontes: Google — notícias, livros, acadêmico — Scirus — Bing. Veja como referenciar e citar as fontes. |
Esta página ou secção foi marcada para revisão, devido a inconsistências e/ou dados de confiabilidade duvidosa (desde junho de 2011). Se tem algum conhecimento sobre o tema, por favor, verifique e melhore a consistência e o rigor deste artigo. Considere utilizar {{revisão-sobre}} para associar este artigo com um WikiProjeto e colocar uma explicação mais detalhada na discussão. |
| A Wikipédia possui o: Portal de Química |
As soluções são compostas por moléculas ou íons comuns. Podem envolver sólidos, líquidos ou gases como dispersantes (chamados de solventes – existentes em maior quantidade na solução) e como dispersos (solutos). A solução também pode apresentar-se nesses três estados da matéria.
É importante destacar que soluções gasosas são formadas apenas por solvente e soluto gasosos.
Em farmácia, uma solução é uma forma farmacêutica líquida, caracterizada pela formação de um sistema onde todas as substâncias sólidas presentes na formulação devem estar totalmente dissolvidas em um veículo adequado. Portanto a solução deve ser líquida e transparente.
Índice |
Classificação das soluções
- Quanto ao estado físico: sólidas, líquidas ou gasosas
- Quanto à condutividade elétrica: eletrolíticas ou não eletrolíticas
- Quanto à proporção soluto/solvente: diluída, concentrada, não-saturada, saturada e supersaturada
Solução saturada, concentrada e diluída
Coeficiente de solubilidade é definido como a máxima quantidade de soluto que é possível dissolver de uma quantidade fixa de solvente, a determinadas temperatura e pressão.A saturação é uma propriedade das soluções que indica a capacidade das mesmas em suportar quantidades crescentes de solutos, mantendo-se homogêneas. Uma solução é dita insaturada se ainda tem capacidade de diluir soluto, sem precipitar excessos. A solução saturada é aquela em que o soluto chegou à quantidade máxima: qualquer adição de soluto vai ser precipitada, não-dissolvida.[1]
Porém, em alguns casos especiais é possível manter uma solução com quantidade de soluto acima daquela que pode ser dissolvida em condições normais. Nesse caso fala-se em solução supersaturada, que é instável: com alterações físicas mínimas a quantidade extra de soluto pode ser precipitada.
- Solução diluída ou insaturada (não saturada)
- Quando a quantidade de soluto usado não atinge o limite de solubilidade, ou seja, a quantidade adicionada é inferior ao coeficiente de solubilidade.
- Solução saturada
- Quando o solvente (ou dispersante) já dissolveu toda a quantidade possível de soluto (ou disperso), e toda a quantidade agora adicionada não será dissolvida e ficará no fundo do recipiente.
- Solução supersaturada
- Acontece quando o solvente e soluto estão em uma temperatura em que seu coeficiente de solubilidade (solvente) é maior, e depois a solução é resfriada ou aquecida, de modo a reduzir o coeficiente de solubilidade. Quando isso é feito de modo cuidadoso, o soluto permanece dissolvido, mas a solução se torna extremamente instável. Qualquer vibração faz precipitar a quantidade de soluto em excesso dissolvida.
Solubilidade nos gases
Os gases apresentam propriedades particulares para a solubilidade. Quando aumenta-se a pressão, a solubilidade aumenta (Lei de Henry). O mesmo não acontece quanto à temperatura. Quando aumenta-se a temperatura, diminui a solubilidade. Assim, a solubilidade é diretamente proporcional à pressão e inversamente proporcional à temperatura. Vale lembrar que essas leis são válidas para qualquer gás, mas não para substâncias em outros estados físicos, como foi mostrado acima.Solubilidade na farmacotécnica
| + Solubilidade na farmacotécnica (em partes de soluto para partes de solvente) | |
| Descrição | Solvente |
|---|---|
| Muito solúvel | menos de uma parte |
| Facilmente solúvel | 1 a 10 partes |
| Solúvel | 10 a 30 partes |
| Pouco solúvel | 30 a 100 partes |
| Levemente solúvel | 100 a 1000 partes |
| Muito pouco solúvel | 1000 a 10000 partes |
| Insolúvel | + de 10000 |
Técnicas especiais de solubilização de fármacos
pH
Grande número de fármacos usados atualmente são ácidos ou bases fracas e as dificuldades para sua solubilização podem ser influenciadas pelo pH do meio. Essas equações baseadas na lei de ação das massas, da físico-química, podem prever a dissolução de ácidos ou bases, em função do pH, com uma precisão alta. Ao solucionar o pH, no entanto outros fatores devem ser considerados. O pH ideal da solução não deve ser mais importante que os requisitos de estabilidade e compatibilidade fisiológicos da formulação.Quando houver necessidade de ajuste do pH, usar um alcalinizante ou acidificante, ou seja, fazer o tamponamento do sistema.
Escolha do tampão
A escolha do tampão adequado deve estar de acordo com os seguintes critérios:- deve ter a capacidade desejada na faixa de pH adequados.
- deve ser atóxico
- não deve interferir na estabilidade do produto
- deve permitir sabor e coloração aceitaveis.
Cossolvente
Os eletrólitos fracos e as moléculas pouco polares apresentam normalmente pouca solubilidade em água. Essa pode ser aumentada pela adição de outro solvente que seja solúvel em água (etanol, sorbitol, propilenoglicol, PEG, etc.).Solubilização
É a passagem de moléculas de um soluto, espontaneamente para uma solução contendo um tensoativo,detergente. O mecanismo resultante tem a ver com a possibilidade das moléculas do soluto serem solubilizadas ou adsorvidas em estruturas denominadas micelas, formadas após a adição gradativa e continuada do tensoativo no sistema.Complexação
Compostos orgânicos em solução tendem a se unir formando complexos de maneira natural. A dissolução de determinado soluto pode ser adequadamente aumentada pela adição de um agente complexante. Com isto o soluto pode ser completamente dissolvido. No entanto deve ser analisado se o complexo resultante não irá afetar a eficácia e a segurança terapêutica.Modificação química
Muitas formulações pouco solúveis em água podem ser modificadas quimicamente. Um exemplo é a betametasona, um corticosteróide, modificado quimicamente.- Betametasona - solubilidade 5,8 mg/100 mL a 25 °C
- Éster-21 de Betametasona fosfato dissódico - solubilidade de 10 g/100 mL a 25 °C
Expressões de concentração
A quantidade de soluto dissolvida em uma quantidade de solvente nos dá um valor que chamamos de concentração da solução. A concentração de uma solução é tanto maior quanto mais soluto estiver dissolvido em uma mesma quantidade de solvente.A concentração das soluções pode ser expressa de diversas formas. O que se entende simplesmente por concentração é a quantidade de soluto existente em relação ao volume da solução. Matematicamente,
C=m/V; onde m é a massa de soluto e V o volume da solução.A unidade usual para concentração é gramas por litro (g/L).
Há outros tipos de cálculo para a concentração em soluções, uma muito difundida refere-se à massa molar do soluto dissolvida num dado volume de solução:
CM=n/V onde n=m/M
CM= concentração molar [mol/l]
n=número de mols de soluto [mol]
V= volume da solução [litro]
M= massa molar do soluto [g/mol]
Quando duas soluções têm a mesma concentração, elas são chamadas isotônicas ou isosmóticas (iso= igual).Quando a concentração é diferente, a mais concentrada é chamada hipertônica ou hiperosmótica (hiper=superior) e a menos concentrada é chamada hipotônica ou hiposmótica (hipo=inferior).
Outros possíveis significados de solução
- Mistura de um soluto com um solvente
- Uma fase líquida, gasosa ou sólida contendo dois ou mais componentes dispersos uniformemente na fase.
- Mistura homogênea de duas ou mais substâncias
Ver também
Cadeia Carbonica
Cadeia carbônica
Origem: Wikipédia, a enciclopédia livre.
| Este artigo ou se(c)ção cita fontes fiáveis e independentes, mas elas não cobrem todo o texto (desde dezembro de 2012). Por favor, melhore este artigo providenciando mais fontes fiáveis e independentes, inserindo-as em notas de rodapé ou no corpo do texto, nos locais indicados. Encontre fontes: Google — notícias, livros, acadêmico — Scirus — Bing. Veja como referenciar e citar as fontes. |
| Esta página precisa ser reciclada de acordo com o livro de estilo (desde Fevereiro de 2008). Sinta-se livre para editá-la para que esta possa atingir um nível de qualidade superior. |
Índice |
Classificação
- Abertas ou Acíclicas ou Alifáticas
- Fechadas ou Cíclicas ou Alicíclicas
- Mistas - apresentam carbonos livres em extremidades e também possuem anel.
Cadeias Abertas ou Acíclicas
Aquelas em que os átomos de carbono ligam-se entre si formando as cadeias com extremos livres- Subdividem-se
- [1]
- Quanto à natureza
- Homogêneas:quando só tem carbonos ligados entre si, não apresenta heteroátomo na cadeia.
- Heterogêneas: Cadeias têm pelo menos um átomo diferente de carbono e hidrogênio, localizado entre átomos de carbono (pelo menos um heteroátomo) .
- Quanto à Disposição
- Normais (chamada também de "reta" ou linear): os carbonos da cadeia são primários ou secundários.
- Ramificadas: possui carbono terciário ou quaternário na cadeia (ramificações).
- Quanto à Saturação
- Saturadas: Cadeias com ligações simples entre carbonos.
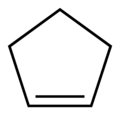
- Insaturadas: Cadeias com ligações duplas, triplas ou ambas, entre carbonos.
- Cadeia carbônica Homogênea, Insaturada e normal:


- Cadeia Carbônica Homogênea, Saturada e Ramificada:
Cadeias Cíclicas ou Fechadas
São aquelas em que os átomos de carbono se ligam formando um anel (ou um círculo fechado), ou que fazem ciclos podendo ser geométricos (quadrado, triangulo) ou nãoDivisão
- Alicíclicas:[1]
- Podem ter qualquer número de átomos de carbono na cadeia e não constituem um anel benzênico.
- Aromáticas:
- Possuem uma cadeia carbônica especial chamada de Anel Benzênico ou Núcleo Benzênico; Anel Aromático ou Núcleo Aromático, formada por seis átomos de carbono e seis átomos de hidrogênio em uma disposição especial de ligações simples e duplas que se alternam. O principal composto se chama Benzeno.
- Fórmula molecular:
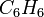
- Fórmula Estrutural,
 |
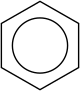 |
| Fórmula estrutural do benzeno | Fórmula estrutural do benzeno simplificada |
- 1 - As Alicíclicas subdividem-se em
- [1]
- Quanto a natureza
- Homocíclicas: As cadeias carbônicas cíclicas possuem somente átomos de carbono e hidrogenio.
- Heterocíclicas: cadeias carbônicas possuem pelo menos um heteroátomo(qualquer átomo diferente de carbono e hidrogênio que esteja localizado entre átomos de carbono).
- Quanto a saturação
- Saturadas: As cadeias carbônicas possuem ligações simples.
- Insaturadas: As cadeias carbônicas possuem ligações duplas, triplas ou ambas.
Exemplo
- 2 - Aromáticas
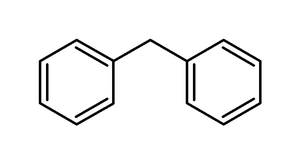
- Mononucleares: Cadeias carbônicas que possuem apenas um anel benzênico.
- Polinucleares: Cadeias carbônicas que possuem mais de um anel benzênico. Que podem se subdividir em :
- Núcleos Isolados: Os anéis aromáticos na cadeia carbônica estão separados distintamente.
- Núcleos Condensados: Possuem outras cadeias carbônicas germinadas ou condensadas ao anel aromático.
Exemplos
- Núcleos Isolados:
- Núcleos Condensados:
- 3 - Cadeias Carbônicas Mistas
- Quando apresentam diferentes tipos de cadeias carbônicas.
- Núcleos Semi-condensados
Exemplos
- Cadeias Carbônicas Mistas:
 |
 |
| Nicotina | Indol |
Referências
| Este artigo sobre Química é um esboço. Você pode ajudar a Wikipédia expandindo-o. |
Quimica Organica
Química orgânica
Origem: Wikipédia, a enciclopédia livre.
| Este artigo ou se(c)ção cita fontes fiáveis e independentes, mas elas não cobrem todo o texto (desde junho de 2010). Por favor, melhore este artigo providenciando mais fontes fiáveis e independentes, inserindo-as em notas de rodapé ou no corpo do texto, nos locais indicados. Encontre fontes: Google — notícias, livros, acadêmico — Scirus — Bing. Veja como referenciar e citar as fontes. |
Em 1828, Friedrich Wöhler , discípulo de Berzelius, a partir do aquecimento de cianato de amônio, produziu a ureia; começando, assim, a queda da teoria da força vital. Essa obtenção ficou conhecida como síntese de Wöhler. Após, Pierre Eugene Marcellin Berthelot realizou toda uma série de experiências a partir de 1854 e em 1862 sintetizou o acetileno. Em 1866, Berthelot obteve, por aquecimento, a polimerização do acetileno em benzeno e, assim, é derrubada a Teoria da Força Vital.
Percebe-se que a definição de Bergman para a química orgânica não era adequada, então, o químico alemão Friedrich August Kekulé propôs a nova definição aceita atualmente: “Química Orgânica é o ramo da Química que estuda os compostos do carbono”. Essa afirmação está correta, contudo, nem todo composto que contém carbono é orgânico, por exemplo o dióxido de carbono, o ácido carbônico, a Grafite, etc, mas todos os compostos orgânicos contém carbono.
Essa parte da química, além de estudar a estrutura, propriedades, composição, reações[1] e síntese de compostos orgânicos que, por definição, contenham carbono, pode também conter outros elementos como o oxigênio e o hidrogênio. Muitos deles contêm nitrogênio, halogênios e, mais raramente, fósforo e enxofre.
Índice |
Características
Dentro da química orgânica existem as funções orgânicas (compostos ôrganicos de características químicas e físicas semelhantes). Existem muitas funções, sendo as mais comuns:- Hidrocarbonetos (Alcanos, Alcenos, Alcinos, Alcadienos, Alceninos, Cicloalcanos, Cicloalcenos)
- A capacidade do carbono de formar ligações covalentes com ele mesmo. São solventes dos compostos orgânicos: o éter e o álcool, por exemplo.
- O raio atômico relativamente pequeno do Carbono em relação aos outros elementos da família 4A.
- Sua eletronegatividade não é muito forte, podendo reagir sem precisar de grandes somas de energia.
- Elemento muito abundante.
Características do Carbono
- O carbono é tetravalente, ou seja, por possuir 4 elétrons na camada de valência efetua 4 ligações.
- Ligações múltiplas, isto é, forma ligações simples, dupla e triplas.
- O caráter da ligação é anfótero (não importa se é metal ou não-metal).
- Formar cadeias carbônicas
- Possui 3 hibridizações: sp³, sp² e sp.
Nomenclatura dos compostos orgânicos
Na química orgânica, compostos orgânicos são nomeados de acordo com seus devidos prefixos, infixos e sufixos:Prefixo
O prefixo é adotado conforme o número de Carbonos na cadeia principal- 1 Carbono: Met-
- 2 Carbonos: Et-
- 3 Carbonos: Prop-
- 4 Carbonos: But-
- 5 Carbonos: Pent-
- 6 Carbonos: Hex-
- 7 Carbonos: Hept-
- 8 Carbonos: Oct-
- 9 Carbonos: Non-
- 10 Carbonos: Dec-
Infixos
É indicado pela classificação da cadeia quanto à saturação: Saturada possuem apenas ligações simples entres os carbonos. Insaturadas possuem ligações duplas ou triplas entre carbonos.- Apenas ligações simples: -an-
- Ligação dupla: -en-
- Duas ligações duplas: -dien-
- Três ligações duplas: -trien-
- Ligação tripla: -in-
- Duas ligações triplas: -diin-
- Três ligações triplas: -triin-
- Uma ligação dupla e uma tripla: -enin-
Sufixos
Os sufixos são colocados conforme a função orgânica do composto.- Hidrocarbonetos: -o
- Ácidos Carboxílicos: Ácido + -óico
- Cetonas: -ona
- Aldeídos: -al
- Álcoois ou fenóis: -ol
- Ésteres: -oato de -ila, onde -ila é o sufixo adotado para o radical.
- Éteres: Radical menor + -oxi- + radical maior
- Aminas: Radical + -amina
- Amidas: Radical + -amida
Exemplo de nomenclaturas de compostos orgânicos
- Metano
- Número de carbonos: Met- = 1 Carbono
- Tipo de ligação entre os Carbonos: -an- = Simples
- Função química do composto: -o = Hidrocarboneto
- Butano
- Número de carbonos: But- = 4 Carbonos
- Tipo de ligação entre os Carbonos: -an- = Simples
- Função química do composto: -o Hidrocarboneto
- Etanol
- Número de carbonos: Et- = 2 Carbonos
- Tipo de ligação entre os Carbonos: -an- = Simples
- Função química do composto: -ol = Alcoól
- Etenal
- Número de carbonos: Et- = 2 Carbonos
- Tipo de ligação entre os Carbonos: -en- = Dupla
- Função química do composto: -al = Aldeído
Famílias de compostos orgânicos
Ver Compostos da química orgânicaReações em química orgânica.
- Substituição
- Eliminação
- Reação de Wolff-Kischner
- Rearranjo de Beckmann
- Reação de Diels-Alder (Cicloadição)
- Oxidação de Swern
- Oxidação de um álcool
- Alquilação de Friedel-Crafts
- Reação de Pinner
- Reações de Wurtz e de Wurtz-Fittig
- Reação de Bucherer
- Reação de Cannizzaro
- Reação de Chugaev
- Reação de Claisen
- Reação de Etard
- Redução de Clemmensen
- Reação de Grignard
- Condensação aldólica
- Fermentação acética
- Reação de Ramberg-Bäcklund
Ver também
| A Wikipédia possui o: Portal de Química |
Referências
Ligações externas
| Este artigo sobre Química é um esboço. Você pode ajudar a Wikipédia expandindo-o. |
Iconografia você sabe o que é?
Iconografia
Origem: Wikipédia, a enciclopédia livre.
Esta página ou secção foi marcada para revisão, devido a inconsistências e/ou dados de confiabilidade duvidosa. Se tem algum conhecimento sobre o tema, por favor, verifique e melhore a consistência e o rigor deste artigo. Considere utilizar {{revisão-sobre}} para associar este artigo com um WikiProjeto e colocar uma explicação mais detalhada na discussão. |
A iconografia (do grego "Eykon", imagem, e "graphia", descrição, escrita [1])
é uma forma de linguagem visual que utiliza imagens para representar
determinado tema. A iconografia estuda a origem e a formação das
imagens. Na indústria editorial, a iconografia é a pesquisa e seleção
das imagens que serão publicadas em um livro, seja como tema principal
da obra ou como complemento de um texto. A pesquisa iconográfica pode
enriquecer um texto sobre um período histórico com imagens de
esculturas, obras arquitetônicas, quadros ou fotografias de pessoas. O
pesquisador iconográfico pode ser funcionário da editora ou um
profissional independente. A iconografia de uma obra editorial é o
conjunto das imagens que integram essa obra, seja um livro, série ou
coleção.
fonte: http://pt.wikipedia.org/wiki/Iconografia
segunda-feira, 11 de março de 2013
Quimica Organica
Quimica Orgânica

As cadeias de carbono são seu grande enfoque de estudo.
As substâncias orgânicas já existiam na pré-história. Um composto
orgânico que prova esta afirmação é o álcool etílico, o qual surgiu da
primeira fermentação do suco de uva, tal reação deu origem ao vinho. Já a
disciplina Química Orgânica surgiu para estudar o Carbono, mas o que
torna este elemento essencial na formação dos compostos orgânicos? Esta
seção abrange estas e outras propriedades deste elemento fundamental
para a vida. É válido ressaltar que o carbono está presente na
porcentagem de 60 % em massa do organismo humano, como também em todos
os seres vivos.
Conheça as diversas Funções Orgânicas: álcoois, aminas, amidas, cetonas, aldeídos, éteres, entre outras, e como elas se caracterizam. Saiba mais sobre o desenvolvimento da Química Orgânica e como através de seu estudo foi possível determinar as estruturas das substâncias, pois uma vez conhecida a estrutura de um composto era possível sua produção por meio de reações químicas, o que provocou uma evolução na indústria farmacêutica.
Aprenda como é possível ocorrer o fenômeno da Isomeria, caracterizado pela ocorrência de duas ou mais substâncias diferentes que compõem a mesma fórmula molecular e como identificar essa propriedade.
A necessidade de proteger o ambiente nos leva ao estudo dos Polímeros: o material que revolucionou a indústria de plásticos e constitui uma ameaça ambiental, veja de que são formados e porque são poluentes.
E mais! Os Hidrocarbonetos, que são todos os compostos constituídos unicamente por carbono e hidrogênio (C, H), ganham uma seção particular dedicada ao estudo dos alcanos, alcenos e alcinos. Confira!
Conheça as diversas Funções Orgânicas: álcoois, aminas, amidas, cetonas, aldeídos, éteres, entre outras, e como elas se caracterizam. Saiba mais sobre o desenvolvimento da Química Orgânica e como através de seu estudo foi possível determinar as estruturas das substâncias, pois uma vez conhecida a estrutura de um composto era possível sua produção por meio de reações químicas, o que provocou uma evolução na indústria farmacêutica.
Aprenda como é possível ocorrer o fenômeno da Isomeria, caracterizado pela ocorrência de duas ou mais substâncias diferentes que compõem a mesma fórmula molecular e como identificar essa propriedade.
A necessidade de proteger o ambiente nos leva ao estudo dos Polímeros: o material que revolucionou a indústria de plásticos e constitui uma ameaça ambiental, veja de que são formados e porque são poluentes.
E mais! Os Hidrocarbonetos, que são todos os compostos constituídos unicamente por carbono e hidrogênio (C, H), ganham uma seção particular dedicada ao estudo dos alcanos, alcenos e alcinos. Confira!
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
Graduada em Química
Equipe Brasil Escola
Canais de Quimica Orgânica
Artigos de "Quimica Orgânica"
-
Acetileno
-
Adrenalina
-
Alcaloides
-
Alcanos
-
Alcenos
-
Alcinos
-
Álcool etílico
-
Alotropia do Carbono
-
Alotropia do Oxigênio
-
Anilina
-
Benzopireno
-
Capacidade dos compostos orgânicos de formar cadeias
-
Características Gerais
-
Carvão mineral e carvão coque
-
Ciclização das Oses
-
Classificação das Cadeias Carbônicas
-
Classificação das cadeias carbônicas: tipos de ligação
-
Classificação do carbono
-
Composição e Aplicações do Clorofórmio
-
Compostos Aromáticos
-
Compostos quirais
-
Compostos sulfurados
-
Constituição Química e Efeitos da Morfina
-
Descoberta da Estrutura do Benzeno
-
Desidratação Intermolecular dos Álcoois
-
Desidratação Intramolecular dos Álcoois
-
Efeitos eletrônicos de radicais meta e orto-para-dirigentes
-
Estereoquímica na visão de Louis Pasteur
-
Esteroides
-
Esteroides naturais e sintéticos
-
Estrutura e Configuração das Oses
-
Estruturas das proteínas
-
Etileno e frutas maduras: qual a relação?
-
Etoxietano: o principal éter
-
Fórmulas Estruturais do Carbono
-
Fórmulas Moleculares de Compostos Orgânicos
-
Funções orgânicas nos aminoácidos
-
Hibridização
-
Hibridização do tipo sp
-
Hibridização do tipo sp2
-
Hibridização do tipo sp3
-
Hidratação de alcinos
-
Hidratos de carbono
-
Hidrocarbonetos
-
Hidrocarbonetos aromáticos
-
Lipídios
-
Mecanismos de reações orgânicas
-
Melatonina
-
Metano
-
Métodos de obtenção de aldeídos e cetonas
-
Métodos de preparação dos álcoois
-
Moléculas orgânicas polares e apolares
-
Nomenclatura de alcanos com mais de dez carbonos
-
Nomenclatura de cadeias ramificadas
-
Nomenclatura de Hidrocarbonetos cíclicos e ramificados
-
Nomenclatura de Ramificações
-
Nomenclatura dos Ácidos Carboxílicos
-
Nomenclatura dos Alcanos
-
Nomenclatura dos Alcenos
-
Nomenclatura dos Alcinos
-
Nomenclatura dos Ésteres
-
Nomenclatura IUPAC
-
O que é o pré-sal
-
Óleo de Babaçu: produção de N-parafina
-
Óleos essenciais
-
Óxi - Uma droga mais devastadora e letal que o crack
-
Oxidação branda
-
Oxidação de Alcenos
-
Oxidação dos álcoois
-
Oxidação energética de alcenos
-
Ozônio
-
Ozonólise de alcenos
-
Polaridade dos compostos orgânicos
-
Polaridade e temperatura de ebulição dos compostos orgânicos
-
Polietileno
-
Postulados do Carbono
-
Produção de Etanol
-
Produtos Orgânicos
-
Propriedades dos compostos orgânicos
-
Quebra catalítica de hidrocarbonetos
-
Química orgânica do século XXI
-
Química orgânica: como tudo começou?
-
Radicais dirigentes no anel benzênico
-
Radicais em Química Orgânica
-
Ramificações de hidrocarbonetos
-
Reação de oxidação de aldeídos e cetonas
-
Reação de saponificação
-
Reações de Adição
-
Reações de Adição em Alcinos
-
Reações de Adição em Dienos
-
Reações de Alquilação de Friedel-Crafts
-
Reações de Esterificação
-
Reações de Substituição em Haletos Orgânicos
-
Reações de substituição em hidrocarbonetos
-
Reações de Sulfonação
-
Reações de Transesterificação
-
Reações em aromáticos
-
Reações Orgânicas de Halogenação
-
Reações Orgânicas de Nitração
-
Regra de Markovnikov
-
Ressonância
-
Síntese da ureia
-
Temperatura de ebulição dos compostos orgânicos
-
Terpenos
-
Tipos de reações orgânicas
-
TNT – Trinitrotolueno
Assinar:
Postagens (Atom)